Inhaltsverzeichnis
Produktbeschreibung
Gebrauchsinformation
Bezeichnung des Tierarzneimittels
Procox 0,9 mg/ml + 18 mg/ml Suspension zum Eingeben für Hunde
Emodepsid/Toltrazuril
Anwendungsgebiete
Für Hunde, bei denen eine parasitäre Mischinfektion vorliegt oder der Verdacht einer parasitären Mischinfektion durch Rundwürmer und Kokzidien der folgenden Arten besteht:
Rundwürmer (Nematoden)
- Toxocara canis (unreife und reife adulte Stadien, L4)
- Uncinaria stenocephala (reife adulte Stadien)
- Ancylostoma caninum (reife adulte Stadien)
- Trichuris vulpis (reife adulte Stadien)
Kokzidien:
- Isospora ohioensis Komplex
- Isospora canis
Die Behandlung reduziert die Ausbreitung einer Infektion mit Isospora, ist aber nicht wirksam gegen klinische Symptome bei bereits infizierten Tieren.
Zieltierarten
Hund
Genehmigungsdatum der Packungsbeilage
Januar 2021
Detaillierte Angaben zu diesem Tierarzneimittel finden Sie auf der Website der Europäischen Arzneimittel-Agentur unter http://www.ema.europa.eu/.
Weitere Angaben
Procox Suspension zum Eingeben wird in zwei verschiedenen Packungsgrößen bereitgestellt, die 7,5 oder 20 ml beinhalten.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Zusammensetzung
Wirkstoff(e) und sonstige Bestandteile:
1 ml enthält:
Wirkstoffe:
Emodepsid 0,9 mg
Toltrazuril 18 mg
Sonstige Bestandteile:
Butylhydroxytoluol (E321; als Antioxidans) 0,9 mg
Sorbinsäure (E200; als Konservierungsstoff) 0,7 mg
Gegenanzeigen
Nicht anwenden bei Hunden/Welpen, die jünger als 2 Wochen oder leichter als 0,4 kg sind. Nicht anwenden bei Überempfindlichkeit gegenüber den Wirkstoffen oder einem der sonstigen Bestandteile.
Nebenwirkungen
Mild verlaufende und vorübergehende Störungen des Verdauungstraktes (z.B. Erbrechen oder ungeformter Kot) können in sehr seltenen Fällen auftreten.
Die Angaben zur Häufigkeit von Nebenwirkungen sind folgendermaßen definiert:
- Sehr häufig (mehr als 1 von 10 behandelten Tieren zeigen Nebenwirkungen)
- Häufig (mehr als 1 aber weniger als 10 von 100 behandelten Tieren)
- Gelegentlich (mehr als 1 aber weniger als 10 von 1000 behandelten Tieren)
- Selten (mehr als 1 aber weniger als 10 von 10.000 behandelten Tieren)
- Sehr selten (weniger als 1 von 10.000 behandelten Tieren, einschließlich Einzelfallberichte)
Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier/Ihren Tieren feststellen, oder falls sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte Ihrem Tierarzt oder Apotheker mit.
Anwendung
Dosierung für jede Tierart, Art und Dauer der Anwendung
Dosierungs- und Behandlungsschema:
Zum Eingeben bei Welpen, die älter als 2 Wochen und mindestens 0,4 kg schwer sind.
Die empfohlene Mindestdosis ist 0,5 ml / kg Körpergewicht, entsprechend 0,45 mg Emodepsid / kg Körpergewicht und 9 mg Toltrazuril / kg Körpergewicht.
Empfohlene Volumina sind in der unten angeführten Tabelle aufgelistet:
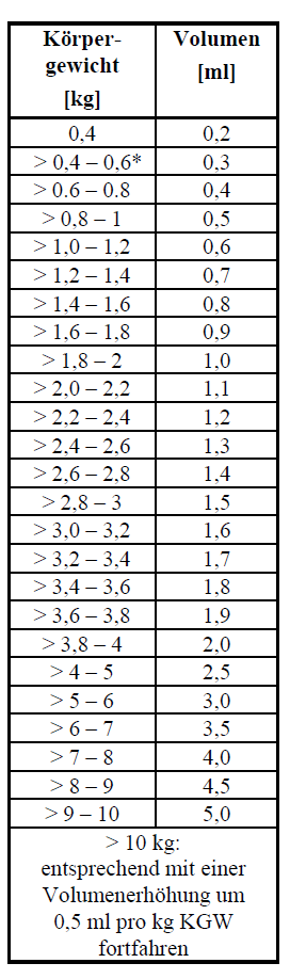
* = mehr als 0,4 kg und bis zu 0,6 kg
Eine einmalige Anwendung ist im Allgemeinen ausreichend, um die Ausbreitung von Isospora Oocysten zu verringern. Wiederholungbehandlungen sind nur dann angezeigt, wenn Mischinfektionen mit Kokkzidien und Nematoden weiterhin (durch den Tierarzt) vermutet oder nachgewiesen werden.
Hinweise für die richtige Anwendung
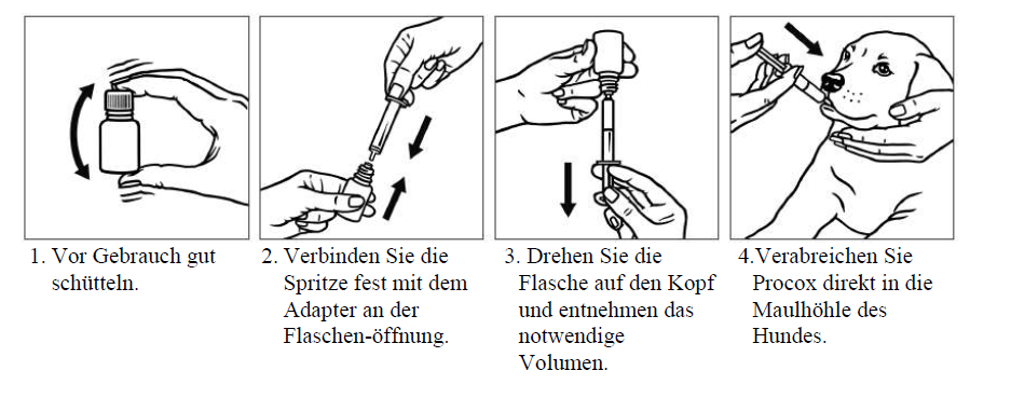
1. Vor Gebrauch gut schütteln.
2. Entfernen Sie die Schraubverschlusskappe. Verwenden Sie für jede Behandlung eine Einwegspritze mit Luer-Konus. Um eine möglichst genaue Dosierung bei der Behandlung von Hunden mit bis 4 kg Körpergewicht zu gewährleisten, sollte eine Spritze mit 0,1 ml Graduierung benutzt werden. Für Hunde mit mehr als 4 kg Körpergewicht kann eine Injektionsspritze mit 0,5 ml Graduierung verwendet werden. Setzen Sie die Spritze auf den Adapter an der Flaschenöffnung fest auf.
3. Drehen Sie die Flasche auf den Kopf und entnehmen das notwendige Volumen. Drehen Sie die Flasche wieder in eine aufrechte Position, bevor Sie die Spritze entfernen. Verschließen Sie den Behälter wieder mit der Verschlusskappe.
4. Verabreichen Sie Procox direkt in die Maulhöhle des Hundes. Entsorgen Sie die Spritze nach der Behandlung, da eine Reinigung nicht möglich ist.
Wartezeit
Nicht zutreffend
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Sie dürfen das Tierarzneimittel nach dem auf dem Etikett und dem Karton nach „Verw(endbar) bis“ angegebenen Verfallsdatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Haltbarkeit nach dem ersten Öffnen des Behältnisses: 10 Wochen.
Für dieses Tierarzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Besondere Warnhinweise
Besondere Warnhinweise für jede Zieltierart:
Die Behandlung mit Procox verhindert die Ausbreitung von Isospora Infektionen, nicht aber die klinischen Symptome (z.B. Durchfall) bei bereits infizierten Tieren. Bei Durchfall können zusätzliche Behandlungsmaßnahmen durch den Tierarzt notwendig sein.
Es ist wichtig, Hygienemaßnahmen durchzuführen, insbesondere, für eine saubere und trockene Umgebung zu sorgen, um Reinfektionen aus der Umgebung zu verhindern.
Isospora Ooysten sind resistent gegen viele Desinfektionsmittel und in der Umwelt über einen langen Zeitraum überlebensfähig. Die unverzügliche Entfernung von Kot (innerhalb von 12 h) reduziert die Wahrscheinlichkeit der Infektionsübertragung. Alle Hunde in einer Gruppe, bei denen ein Infektionsrisiko besteht, sollten gleichzeitig behandelt werden.
Wie bei jedem Antiparasitikum kann sich nach häufiger und langfristiger Anwendung von Anthelminthika oder Antiprotozoika einer Substanzklasse eine Resistenz gegen diese Substanzklasse entwickeln. Ein angemessenes, durch einen Tierarzt erstelltes Behandlungsschema gewährleistet eine adäquate Parasitenkontrolle und vermindert die Wahrscheinlichkeit der Entwicklung von Resistenzen.
Besondere Vorsichtsmaßnahmen für die Anwendung bei Tieren
Die Anwendung von Procox bei Collies oder verwandten Rassen, bei denen der Verdacht auf Vorliegen eines MDR1 -/- Gendefektes besteht, oder die Träger eines MDR1 -/- Gendefektes sind, wird nicht empfohlen, da die Verträglichkeit des Produktes in MDR1 -/- gendefekten Welpen geringer ist, als in anderen Welpen.
Es liegen nur begrenzte Erfahrungen in der Behandlung von stark geschwächten Hunden sowie Hunden mit stark eingeschränkter Nieren- oder Leberfunktion vor. Bitte teilen Sie ihrem Tierarzt mit, ob solche Erkrankungen bei ihrem Hund vorliegen.
Besondere Vorsichtsmaßnahmen für den Anwender
Während der Anwendung nicht essen, trinken oder rauchen.
Nach der Anwendung Hände waschen.
Versehentlich auf die Haut des Anwenders gelangte Reste des Tierarzneimittels sofort mit Wasser und Seife entfernen.
Wenn das Tierarzneimittel versehentlich in die Augen gelangt ist, müssen diese sorgfältig mit viel Wasser gespült werden.
Wenn das Tierarzneimittel versehentlich geschluckt wurde, insbesondere wenn Kinder betroffen sind, ist unverzüglich ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Trächtigkeit
Die Unbedenklichkeit des Tierarzneimittels bei trächtigen und laktierenden Hündinnen wurde nicht untersucht. Daher wird eine Anwendung bei trächtigen Hündinnen und während der ersten zwei Wochen der Laktation nicht empfohlen.
Wechselwirkungen mit anderen Arzneimitteln und andere Wechselwirkungen
Emodepsid ist ein Substrat für P-Glykoprotein. Die gleichzeitige Behandlung mit anderen Tierarzneimitteln, die P-Glykoproteinsubstrate oder -inhibitoren sind (z. B. Ivermectin und andere antiparasitär wirksame makrozyklische Lactone, Erythromycin, Prednisolon und Cyclosporin) könnte pharmakokinetische Wechselwirkungen hervorrufen. Die möglichen klinischen Folgen solcher Wechselwirkungen wurden nicht untersucht.
Überdosierung (Symptome, Notfallmaßnahmen und Gegenmittel)
Mild verlaufende und vorübergehende Störungen des Verdauungstraktes, wie ungeformter Kot und Erbrechen, traten gelegentlich nach wiederholter Anwendung des Tierarzneimittels bis zum 5-fachen der empfohlenen Dosis auf.
Inkompatibilitäten
Nicht mit anderen Tierarzneimitteln mischen.
Besondere Vorsichtsmaßnahmen für die Entsorgung von nicht verwendeten Arzneimitteln oder von Abfallmaterialien, sofern erforderlich
Arzneimittel sollten nicht über das Abwasser entsorgt werden. Diese Maßnahmen dienen dem Umweltschutz. Das Tierarzneimittel darf nicht ins Grundwasser gelangen, da es gefährlich für Fische und andere Wasserorganismen ist.
Zulassung / Hersteller
NAME UND ANSCHRIFT DES ZULASSUNGSINHABERS UND, WENN UNTERSCHIEDLICH DES HERSTELLERS, DER FÜR DIE CHARGENFREIGABE VERANTWORTLICH IST:
Zulassungsinhaber:
Vetoquinol S.A.
Magny-Vernois
70200 Lure
Frankreich
Für die Chargenfreigabe verantwortlicher Hersteller:
KVP Pharma + Veterinär Produkte GmbH
Projensdorfer Str. 324
24106 Kiel
Deutschland

